Замена редкоземельного элемента европием позволяет лучше контролировать превращение СО в топливо!
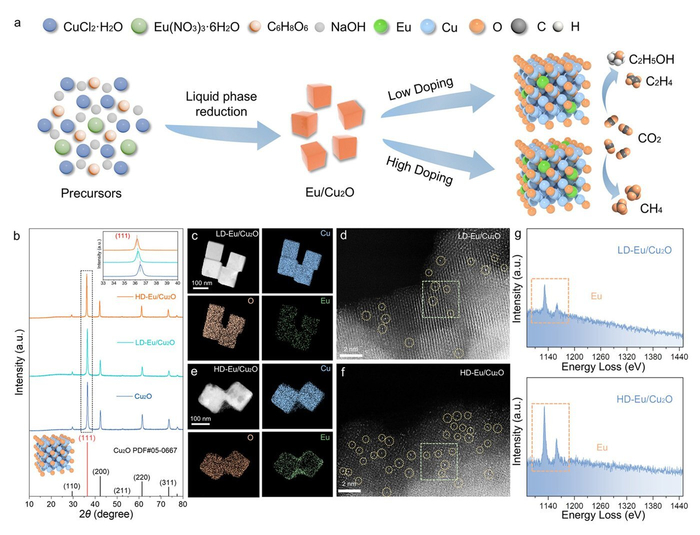
Синтез и характеристики структуры. Дизайн и свойства LD-Eu/Cu₂O и HD-Eu/Cu₂O. (а) Схема синтеза Eu/Cu₂O. (б) Дифракция LD, HD и Cu₂O. (в) Картирование LD. (г) STEM-HAADF LD. (д) Картирование HD. (е) STEM-HAADF HD. (ж) Схемы EELS.
Электрохимическое восстановление CO2, также известное как процесс, при котором углекислый газ (CO2) подвергается химической трансформации с помощью электрической энергии, представляет собой передовую технологию в области борьбы с изменением климата. Этот метод позволяет поглощать вредные парниковые газы, выделяемые промышленностью и транспортом, и преобразовывать их в полезные вещества. Например, CO2 может быть превращен в топливо, такое как метан (CH4) или этилен (C2H4), а также в другие химикаты, которые могут использоваться в различных отраслях. Однако, несмотря на огромный потенциал, одно из главных препятствий заключается в сложности избирательного управления реакцией. Различные процессы восстановления могут вести к различным продуктам — от простых соединений с одним атомом углерода (C1, например, CO или CH4) до более сложных с двумя или более атомами углерода (C2+, такие как этанол или ацетилен). Таким образом, адаптация этих процессов для достижения конкретного желаемого результата — будь то топливо для автомобилей, сырье для пластиков или химикаты для фармацевтики — остается технически сложной задачей. Исследователи стремятся разработать методы, которые позволили бы предсказывать и контролировать исход реакции с высокой точностью, чтобы минимизировать побочные продукты и повысить эффективность.
"Мы стремимся к тому, чтобы адаптировать эту реакцию так, чтобы каждый раз точно предсказывать результат и полностью контролировать его", — объясняет Хао Ли, заслуженный профессор Института передовых исследований материалов (WPI-AIMR) при Университете Тохоку в Японии. Этот институт специализируется на междисциплинарных исследованиях в области материаловедения, и команда Ли работает над интеграцией химии, физики и инженерии для решения глобальных вызовов устойчивого развития.
Недавно группа ученых из Университета Тохоку под руководством Хао Ли провела groundbreaking исследование, которое проливает свет на механизмы контроля селективности в электрохимическом восстановлении CO2. Они обнаружили, что редкоземельный элемент европий (Eu) играет центральную роль в управлении реакцией, позволяя избирательно направлять процесс к продуктам C1 или C2+. Европий, химический элемент с атомным номером 63, редко используется в электрокатализе из-за его уникальных электронных свойств. Результаты исследования были опубликованы в престижном журнале Американского химического общества (ACS), что подчеркивает их значимость для научного сообщества.
В экспериментах исследователи интегрировали атомы европия в кристаллическую структуру оксида меди (Cu2O), формируя модифицированный катализатор Cu2O-Eu. Ключевым открытием стало то, что концентрация европия напрямую влияет на доминирующий продукт реакции. Когда концентрация Eu была низкой (например, менее 5% атомарного содержания в Cu2O), катализатор способствовал образованию продуктов C2+ с высокой эффективностью. Фарадеевская эффективность — метрика, измеряющая долю электрического тока, используемого для целевой реакции, — достигла почти 80% для C2+ продуктов. Это означает, что около 80% электроэнергии шло на создание ценных веществ, таких как этилен или ацетальдегид, вместо побочных реакций. Напротив, при более высокой концентрации Eu (скажем, свыше 10%) катализатор смещал реакцию в сторону продуктов C1, таких как метан (CH4), конечный газообразный продукт, полезный в качестве топлива.
Чтобы понять основы этого механизма, исследователи провели теоретические расчеты с использованием квантовой химии и моделей молекулярной динамики, а также провели дополнительные наблюдения in situ (в реальном времени) с помощью методов спектроскопии. Они установили, что европий действует как электронный модулятор, изменяя электронную структуру катализатора в зависимости от своей концентрации. При низких уровнях Eu ослабляются определенные химические связи в промежуточном продукте реакции, известном как *CHO (гидрокарбонильный радикал, связанный с катализатором). Это ослабление препятствует полному гидрированию (добавлению атомов водорода), позволяя двум углеродным радикалам связаться между собой (соединение C-C), что приводит к образованию более сложных C2+ молекул. В контрасте, при высоких концентрациях Eu эти же связи укрепляются, способствуя глубокому гидрированию *CHO в CH4 по пути C1, где углерод полностью насыщается водородом и образует простой одноатомный продукт.
В своем заключении работа ученых устанавливает четкий механизм переключения между продуктами C1 и C2+ в процессе электрохимического восстановления CO2. Европий используется как электронный модулятор в катализаторах на основе Cu2O, что позволяет регулировать реакцию через обратимую окислительно-восстановительную пару Eu3+/Eu2+. Эта пара характеризуется легкостью перехода между зарядными состояниями, влияя на промежуточный *CHO. Исследование демонстрирует, как даже небольшие изменения в электронной структуре катализатора могут избирательно направлять реакцию либо к связыванию C-C (для C2+), либо к глубокому гидрированию (для CH4). Это открывает путь к точному контролю над продуктами, минимизируя непроизводительные потери и повышая общую эффективность процесса.
Кроме того, исследование представляет собой новую концепцию дизайна катализаторов для получения желаемых углеродных продуктов из CO2. Комбинация меди (Cu2O) и редкоземельных элементов, таких как европий, обещает эволюцию в области зеленой химии. Этот подход не только улучшает селективность, но и делает процесс более устойчивым, поскольку использует возобновляемые источники энергии, такие как солнечные панели или ветер, для генерации электричества.
В более широком контексте, такой точный контроль над преобразованием CO2 в топливо и химикаты способствует развитию электрифицированных производств. Это означает переход от традиционных методов, основанных на ископаемом топливе, к новым технологиям, где CO2 служит сырьем для высокоценных продуктов, таких как полимеры, фармацевтические препараты или даже биотопливо. В долгосрочной перспективе подобные инновации могут привести к производству химикатов с нулевым углеродным следом, более эффективному использованию возобновляемой энергии (например, производство "зеленого" водорода или электроэнергии из гелиоэнергетики) и значительному сокращению глобальных выбросов парниковых газов. Это исследование не только углубляет наше понимание катализа, но и подчеркивает роль интердисциплинарных подходов в решении экологических вызовов, потенциально ускоряя переход к углеродно-нейтральной экономике.