Говоря о химической связи, мы часто сталкиваемся с понятием валентность, оно обозначает количество ковалентных связей, которое может образовать атом определённого элемента, например для серы это 2, 4 или 6, для кислорода 2, для углерода 4. Однако иногда атомы образуют значительно больше связей, чем предполагает их валентность, возьмем например медь, она проявляет валентности 1 и 2, однако если растворить её гидроксид (2) в аммиаке и провести анализ полученного вещества, мы установим что в нем содержится 6 молекул аммиака, связанных с атомом меди. Это совершенно не вписывается в рамки привычной теории, и ученые давно это заметили.
Было несколько попыток. Объяснить природу таких соединений, начиная с предположений о переменной валентности, заканчивая теориями цепных соединений. Все они до поры до времени могли объяснять некоторые свойства нового типа соединений, но с открытием всё большего их количества теория постепенно рушилась. Решающую роль в становлении координационной теории сыграл А. Вернер, он не только создал совершенно новое видение проблемы, но и подкрепил свои предположения огромным количеством экспериментов. Разберемся же в основных положениях координационной теории.
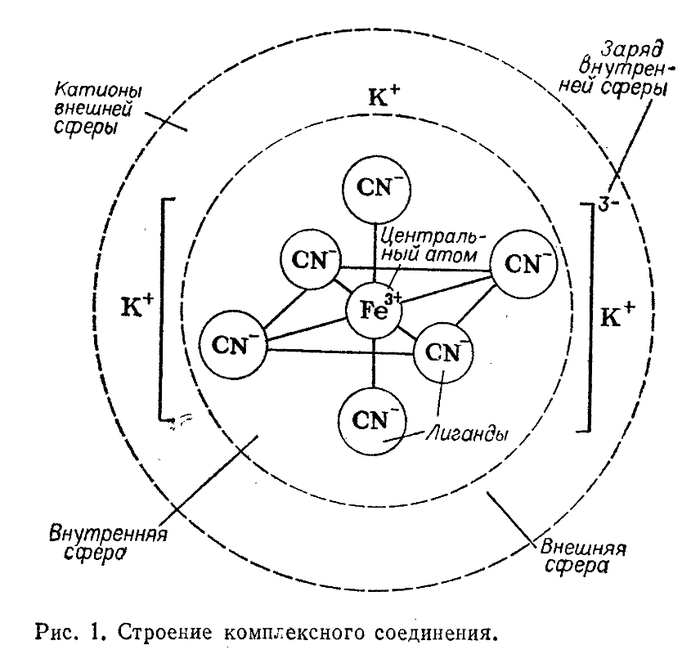
Вернер считал, что некоторые атомы обладают как главной, так и побочной валентностью, сначала насыщается главная, затем побочная. Атомы стремятся заполнить обе эти валентности, отсюда и разнообразие координационных соединений. Тогда природа «побочной» валентности была не известна, сейчас же мы знаем, что она образуется по донорно-акцепторному механизму. Вернер также обозначил структуру координационных соединений, они состоят из центрального атома, внутренней координационной сферы и внешней координационной сферы. Центральный атом обладает свободными орбиталями на внешнем уровне, к нему координируются атомы или молекулы, находящиеся во внутренней координационной сфере, они обладают неподеленной электронной парой, и их называют лигандами. Во внешней же координационной сфере располагаются ионы, компенсирующие заряд центрального атома.
Химия координационных соединений очень разнообразна, поэтому разработана система классификаций как самих комплексов, так и лигандов. Среди координационных соединений выделяют заряженные и незаряженные, у незаряженных либо и центральный атом и лиганды незаряжены, либо заряды скомпенсированы друг другом. Лиганды также могут быть нейтральными или заряженными, занимать одно или несколько «координационных мест», различаться по размеру и форме.
Но почему же Вернер был так уверен в правильности своей теории, неужели свойства лигандов и ионов внешней координационной сферы будут отличаться? Он не знал ни механизмов образования связей, ни её природы, однако свою гениальную догадку он подтвердил множеством экспериментов, он изучал комплексы (так иногда называют координационные соединения) хрома, в которые входил аммиак и хлор, Вернер заметил, что комплексы в которые входят 6 молекул аммиака осаждают 3 эквивалента серебра, если уменьшить количество молекул аммиака до 5 в осадок выпадают 2 эквивалента и т.д. Так Вернер установил, что хром координирует вокруг себя 6 лигандов, и если в их состав входят ионы хлора, взаимодействие последних с ионами серебра затрудняется, следовательно существуют различия между ионами одного и того же элемента, находящегося в внутренней или внешней координационной сфере. Такое поведение не возможно было объяснить ни одной предыдущей теорией, и Вернер в очередной раз доказал верность своих предположений.
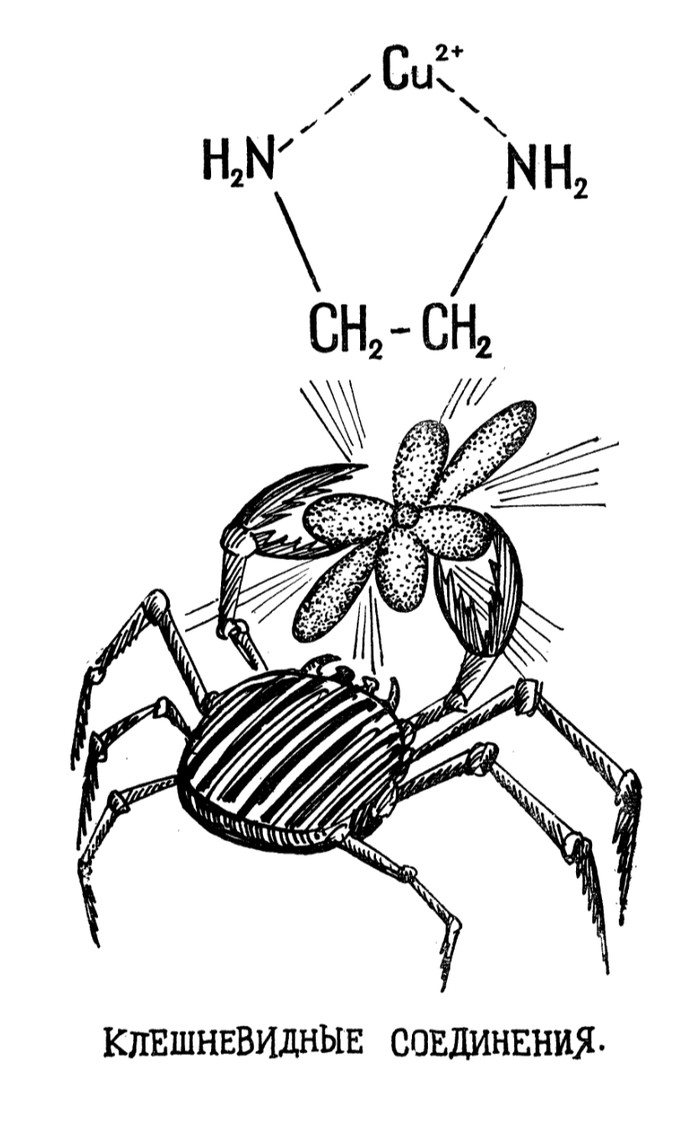
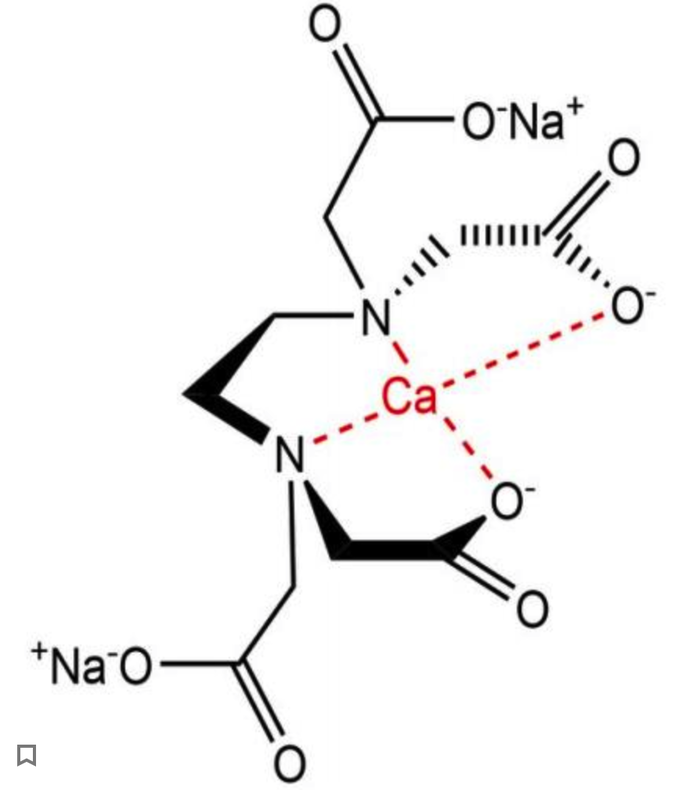
Однако мы здесь не для заучивания теории, а для поиска интересной информации, так что перейдем к более необычным лигандам. Наверняка вы слышали про чистящее средство Трилон-Б, его используют для очистки от накипи чайников и прочего водонагревающего оборудования, так вот задумывались ли вы, как работает это средство? Трилон-Б a.k.a. ЭДТА a.k.a. Этилендиаминтетрауксуснаякислота (а точнее её динатриевая соль) является сложным лигандом, образующим комплексы с кальцием, которые хорошо растворимы в воде и позволяет удалять накипь (карбонат кальция) со стенок вашего чайника. ЭДТА представляет из себя такого «крабика», который захватывает в клешни ион кальция, а за счет атомов азота и возникающих водородных связей, полученный комплекс ещё и растворим в воде.
Продолжая разговор об интересных комплексах поговорим о краун-эфирах, эти замечательные колечки являются перспективными экстракторами, так как, внимание, позволяют регулировать размер иона, который должен оказаться центральным. С помощью краун-эфиров можно добиваться растворения ионов определенных элементов в органическом растворителе, тем самым, выделять их из смеси, так например можно очищать отработанное ядерное топливо (хотя выгоднее и эффективнее использовать трибутилфосфат).
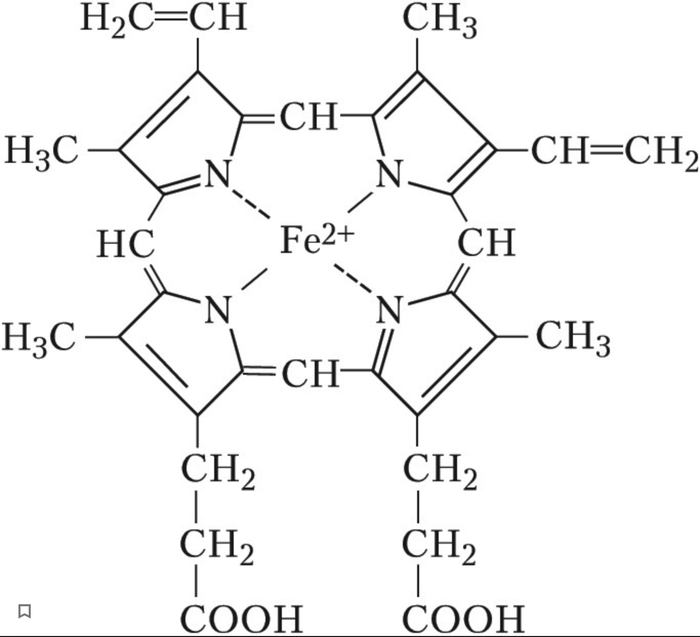
Трудно поверить, но и своему существованию мы обязаны комплексным соединениям, именно порфириновые циклы являются важнейшей частью белков, переносящих кислород, в частности гемоглобина.
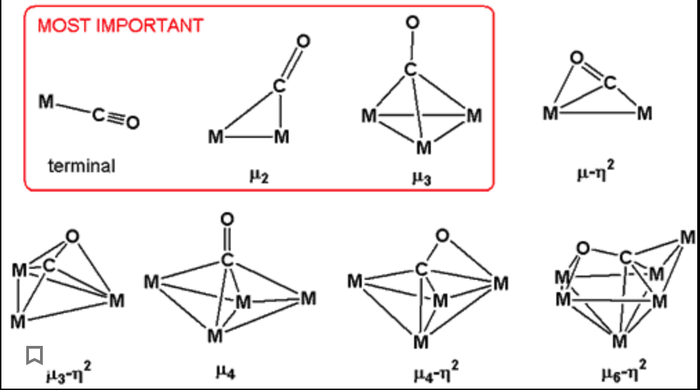
Идем дальше и вспоминаем о существовании карбонилов, нейтральных комплексов переходных металлов с угарным газом, их особенность состоит в двойственной роли металла, он одновременно и донор и акцептор электронной пары, то есть может выполнять роль лиганда, а молекулы CO являются как лигандами, так и иногда мостиковыми атомами, из-за чего структуры карбонилов весьма разнообразны. Также именно в карбонилах переходные металлы могут принимать отрицательные степени окисления.
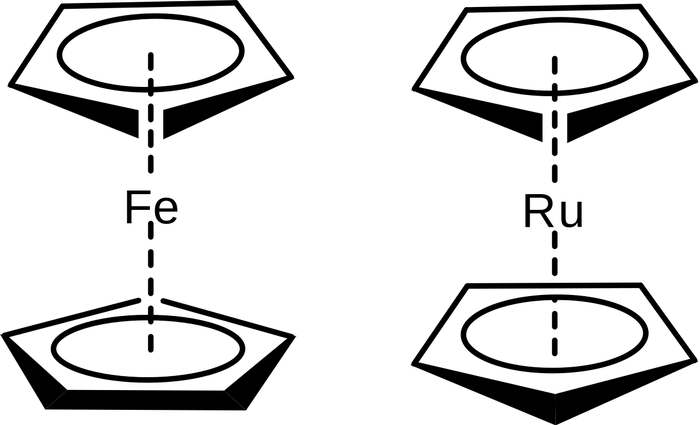
А теперь настало время отличных историй) Германия достаточно бедна такими полезными ископаемыми как нефть и газ, и поэтому во время войны, когда армия нуждалась в топливе для танков и автомобилей, необходимый бензин синтезировали из угля, которого в стране было предостаточно. Так вот, на одном из заводов, где синтезировали бензин в трубах и реакторах откладывалось ярко-оранжевое вещество, состав которого немцам установить не удалось. Странное вещество извлекали и захороняли. Спустя много лет о захоронениях вспомнили и решили посмотреть, что же это было за вещество, оказалось, что оно принадлежит новому классу «сэндвичных» соединений и представляет из себя бутерброд из иона железа и двух циклопентадиениловых лигандов, вещество назвали ферроцен. Позже были получены и другие представители нового класса соединений, центральными атомами в которых являлись переходные металлы. Если вы думаете, что сэндвичные соединения это большая редкость, и они не находят практического применения, то знайте, что все литиевые аккумуляторы, которыми мы пользуемся, осуществляют циклы зарядки и разрядки благодаря образованию соединений внедрения ионов лития в графит. В этом процессе образуется полимер, представляющий из себя множество сэндвичей из фрагментов графита и начинки из атомов лития. Такие аккумуляторы не только более долговечны, но и компактны, так как плотность лития увеличивается при интеграции в графит. (Можете почитать про соединения внедрения здесь.)
Иллюстрации взяты из замечательной книги Ю.А. Макашева и В.М. Замяткиной "Соединения в квадратных скобках", если хотите познакомиться с комплексными соединениями поближе обязательно прочитайте.