Гаптен, быть может, порождает,
И тримепиридина он слабей,
Но буйство красок окисленья пробуждает
Знакомый наш среди лекарственных "солей"...
Нужных ионов вам, уважаемые подписчики сообщества и читатели! Нередко бывает так, что проводимые самостоятельно химические реакции поражают не только своими продуктами, но и восхитительными цветовыми переходами, которыми они сопровождаются. Если вы читали предыдущие посты про хлоргексидин и сочли это своего исключением из мира фармацевтики, то вы ошиблись. Поскольку сегодня речь пойдет о самом незаурядном, по моему мнению, художнике среди лекарственных препаратов.
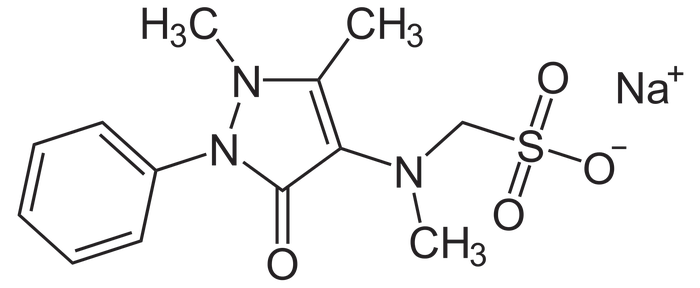
Познакомьтесь, это анальгин (он же метамизол натрия)
Это лекарственное вещество сейчас хоть и продается в аптеках отдельно или в совокупности с другими веществами, но в остальном мире на него долго точили зуб, покуда вовсе не запретили.
В Великобритании метамизол выведен из фармацевтического рынка в 1965 году. В Норвегии изъят из обращения 1976 году. В США изъят из обращения в 1977 г. В Саудовской Аравии запрещён с 1980 г. В ОАЭ изъят из обращения в 1981 г. В Израиле метамизол-содержащие комбинированные средства изъяты из обращения с 1985г. В Дании запрещены все метамизол-содержащие препараты с 1979 г. Метамизол изъят из обращения в Малайзии 1987г, в Пакистане, Гане, Нидерландах, Бахрейне, Ирландии, Сингапуре, Венесуэле, Непале, Германии и др. Сейчас метамизол-содержащие средства бесконтрольно используются лишь в России и нескольких развивающихся странах.
Дело было в том, что препарат довольно агрессивно настроен как ко многим другим медикаментам, так и к организму. Выяснилось, что анальгин способен вызывать агранулоцитоз, т.е. заболевание, при котором сильно страдают лейкоциты, их число заметно снижается за счёт гранулоцитов и моноцитов. Я полагаю, что конкретно этот агранулоцитоз имеет иммунную природу, а виноватыми следует считать экзогенные антигены. Эти антигены, носящие название "гаптены", возникают благодаря не только нашему анальгину, но и многим анальгетикам и седативным препаратам.
Неиммуногенные гаптены то и дело вставляют палки в колеса иммунитета, поскольку их природа не позволяет вырабатывать антитела, зато эти тунеядцы легко с ними связываются. Иждивенчество их обеспечивается обычно белками-носителями ("шаперонами"), с которыми гаптены и могут стать иммуногенными, но это для них единственный путь к этому. Результатом порождения гаптенов часто становится не только лейкоцитопения, но и саботаж иммунной реакции (с чем напрямую связан предыдущий дефект). Выявление взаимосвязи анальгина с гаптенами является лишь моим предположением, так что ошибки вполне возможны.
Забыл сказать: анальгин тоже является болеутоляющим, но в связи с вышеуказанными подробностями он не шибко популярен. Гораздо чаще его используют вкупе с антипиретиками и другими анальгетиками, например, в многокомпонентном препарате "Спазмалгон" (с него, кстати, и началось мое знакомство с анальгином). Сам по себе метамизол натрия относительно недорог, так что приобрести его не является задачей сложной.
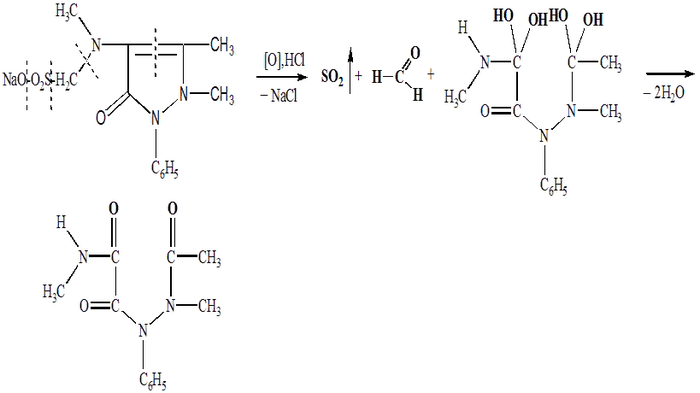
Обратим теперь свой взор на химическую природу анальгина. Метамизол натрия представляет собой довольно сложную сульфоновую кислоту, а точнее, ее натриевую соль. Относится он к нестероидным противовоспалительным препаратам (НПВП), а истоки берет он от пиразолона (пятичленного гетероцикла с двумя гетероатомами азота). Самая яркая его черта - это примечательные восстановительные свойства. Помните аскорбиновую кислоту и наши попытки стабилизировать соли железа против окисления? Так вот теперь, она не одинока, метамизол натрия может составить ей хорошую компанию бытовых восстановителей. Чем же обуславливается такой характер препарата? Причина кроется в неустойчивой и частично гидрированной системе пиразолина и гидразиновой группировки. Метамизол натрия в процессе окисления склонен образовывать свои нестабильные тетраоксипроизводные, имеющие как правило, заметный окрас. Реакции окисления обычно затрагивают именно фрагмент пиразола, но иногда могут расшевелить и другие ф. группы. Что будет с веществом дальше, узнаете в соответствии с планом поста.
Рецепт:
Анальгин (можно "Спазмалгон") - аптека (р-р 1-2 таблеток на четверть стакана воды)
Сульфат железа (III) - перекись водорода + р-р магазинного железного купороса
Иода настойка спиртовая 5% - аптека
Серная разб. к-та - электролит аккумуляторный
Дихромат аммония - вероятно, пиротехнические магазины (у меня от какого-то древнего набора остался).
Гипохлорит натрия - "Белизна".
Начнем же проверять препарат, а начнем мы с довольно простого окислителя - перекиси водорода. Да, я знаю, что она проявляет амфотерные свойства и в зависимости от реакции может быть как окислителем, так и восстановителем. Но у нас здесь имеется товарищ, желающий сбросить с себя электронов, так что перекись будет очень кстати. Чтобы реакция пошла интереснее, позовем еще разб. серку:
На видео вышел маленький косяк: р-р изначально не имел голубого оттенка, всему виной одна неосторожность. Но суть вы узрели: появилось соединение насыщенного синего цвета, которое быстро обесцвечивается.
Далее я провел одну реакцию от которой, честно говоря, ничего не ждал, но результаты меня удивили. В первом видео сначала приливалась перекись, а затем только кислота. Но при повторе я решил сделать наоборот и... остановился на первом этапе:
Снова появляется синий окрас, быстро сходящий на нет спустя секунды.
И вот тут предо мной встал вопрос: разб. кислота тоже окисляет? В школьной химии, например, окислять способны только конц. растворы серной кислоты, а разведенные же ничего такого не творят. Но что тогда мы наблюдали здесь? Ваш сноб (т.е. я) сначала долго воображал, что получил "метамизоловую кислоту" простым вытеснением более слабой. Странным для меня оставался ее цвет и свойства тускнеть с полной потерей цвета, а также удивительное сходство с обычным окислением. И всё-таки я решил, что дело именно в окислении. Каким образом эта серная кислота могла проявить окислительные свойства, остается непонятным. Может, вмешался кислород воздуха? Знатоки, выручайте.
Теперь вы ждете от меня общих пояснений. Упомянутое нами окрашенное тетраоксопроизводное имеет свойство переходить в бесцветное диоксопроизводное. Цикл пиразолина рвется по месту непредельной связи меж двумя атомами углерода, каждый из которых приобретает по две гидроксильных группы. Но для одного углерода столько незваных гостей будет слишком много, поэтому лишнее отстегивается наружу в виде воды, а углероды оставляют себе только по атому кислорода (к кислороду, разумеется, протягивается тоже двойная связь). Так анальгин ведет себя в ответ на окисление. Есть у нас еще, как любят писать в рецептах, tinctura Iodi spirituosa (настойка иода 5%):
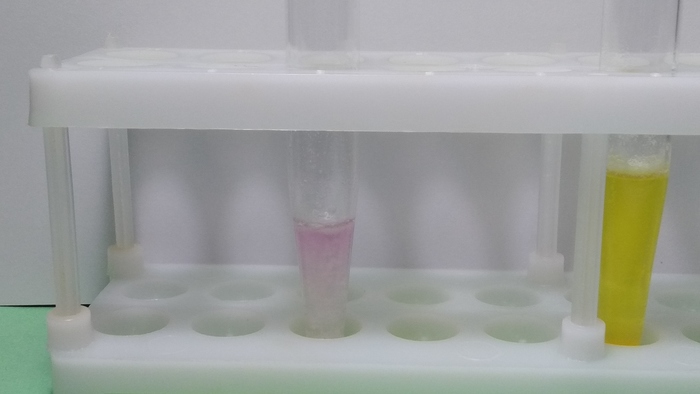
Иод тоже неплохой окислитель, хоть и слабейший среди галогенов (астат и все, что ниже иода не учитываем). Окислить метамизол натрия для него вполне силам. На выходе получаем забавный розовый растворец.
Взаимодействие с иодом идет иначе: в данном случае окисляется не пиразолин, а сульфит-ион метамизола натрия. Переходит он в сульфат, поэтому и игра цвета тут другая. Это реакция нашла себе место в аналитической идентификации препарата (количественно, титрованием).
В качестве заключения нашего лабораторного приключения протестируем еще дихромат аммония. Это один из самых сильных ок-лей в моей лабе, а еще это жутко опасное соединение: ядовит, токсичен, канцерогенен, надменно взрывоопасен и язвительно горюч, в воде прекрасно растворяется. Цвет приятный, апельсиновый, но любоваться им приходится крайне осторожно, даже малые концентрации опасны для организма, а без перчаток к нему и вовсе приближаться не стоит. Благо, что не летучий. С ним часто проводят красочный опыт "вулкан", в ходе которого происходит эффектное извержение оксидом хрома (III), но такие эксперименты слишком опасны для дома. Пробирка же все стерпит:
Дихромат я люблю добавлять всухую, крупицами. Мне-то всё равно, а вам так приятнее и интереснее. Смотрите до конца
Если на секунду отвлечься от занимательной картинки на видео, то станет ясно: принцип реакции не слишком отличается от приведенных. Да, соединение-продукт обладает бордовым цветом, а не синим, но это уже специфика окислителя, вероятно. Хотя, если приглядеться, то в самом начале виден все-таки другой окрас, так что не спешите ворчать.
Можно побаловаться и капнуть гипохлорита натрия. Тоже будет наглядно:
Слева - реакция с гипохлоритом, все типично, ведь он хороший окислитель и все дела. Справа - сульфат железа 3. Вы ожидали восстановления железа? Зря, тут анальгин вас разочарует. Хотя, обратите внимание на первые капли, там явно образуется что-то темное. Потом окрас осветляется.
Если к окисленному гипохлоритом р-ру прилить разб. серной кислятины, то синие промежуточные продукты вновь появятся. Правда, чтобы тут же исчезнуть.
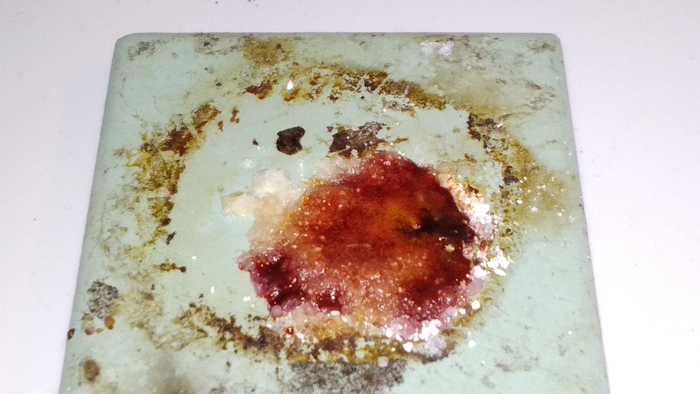
Бонус: синий окрас исчезает, р-р светлеет, а вот потом случается это - после пероксида водорода в кислой среде серки остается фиолетовое кольцо (слева).
Те, кто знаком с фармакопейными реакциями, ждали прогрева с хлороводородом, дабы понюхать формальдегида; ауринового красителя с конц. кислотами, прокаливания с карбонатами. Некоторые из них я просто не могу пока нормально повторить в силу материальной неоснащенности, а некоторые просто неинтересны для обывателя, в отличие от химика. Всё-таки Пикабу - не химический форум, а потому здесь не нужно что-то особенно сложное и непримечательное. Ну а мы продолжаем набирать знания на практике и опыте своих ошибок. И показывать занимательные штуки из тех мелочей, что находятся вокруг нас.
Все выводы, как и всегда, делайте на ваше усмотрение. Если вы считаете, что я ошибся, то так и укажите.